

ver. alpha-2013-12-3
いまだ試行錯誤が続いていますが、 大筋は決まってきたような気がします。 とりあえず現状を公開してみますので、 なにか情報をお持ちの方は教えてください。
ここではコナジラミの蛹殻のスライド標本を作る方法につて述べます。 封入剤としてカナダバルサムを使った永久プレパラートを作ります。 簡易検鏡についても少し書いてみようかと思いますが、そのうち。
高価な機材として、 生物顕微鏡と実体顕微鏡が必要になります。 また劇物・毒物に指定されている薬品 (水酸化カリウム、硫酸銅、キシレン)を使います。 これらの道具と扱える知識を持った方を想定しています。 時間もけっこうかかりますので、 それなりに覚悟を持って望んでください。
専門家の方で知識とお金と設備をお持ちの方は、 もう少しうまい方法があるらしいので、ご自分でお調べください。
作った標本を見るのに使います。 顕微鏡にはいろいろ種類があるようですが、私は詳しくありません。 生物顕微鏡というのが必要らしいです。 私はオリンパスのBHCをヤフオクで3万円強で落としましたが、 カビがものすごくて往生しました。 ある程度掃除しましたが、掃除できない場所もあり、少し見づらいです。 対物レンズは10倍、20倍、40倍を使用しています。 写真撮影ができないと面白くないでしょう。
私はレイマーという会社の安い実体顕微鏡(新品で1万円強)を使ってます。 もっと高い倍率のものが欲しいです。
劇物・毒物に指定されている薬品(KOH、硫酸銅、キシレン)を使います。 これらは劇物を扱っている薬局から購入できますが、 少なくなっているようです(もうからないみたい)。 電話して探してください。 ネットでは買えませんし、 郵送、宅配等も禁止されているので、薬局から買うしかありません。 購入するときに判子が必要になり、何に使うか書かされます。

Fig. 1-3 水酸化カリウム、硫酸銅(II)、キシレン |

Fig. 1-4 消毒用エタノール、無水エタノール、 アンモニア水、オキシドール、 クローブオイル、カナダバルサム |
(1) 水酸化カリウム。 別名苛性カリ。化学式KOH。 フレーク状(薄い板状)とペレット状(粒状)のものがありますが、 ペレット状の方が扱いやすいと思います。 写真は500g入りで10万匹ぐらい処理できそうです。 25gぐらいで小売りされているといいんですが…。 水酸化カリウムは潮解性があるので、 フタをしっかりしめておきます。
(2) 硫酸銅(II)。 IとIIがあるようなんですが? 100%エタノールを作るために使います。 加熱すると再利用できるため、 25g入りで十分なんですが、 扱っていなかったので500g入りを購入しました。 どうしよう…。
(3) キシレン。 石油系の溶剤です。 火災の危険があるので、保管に注意してください。
(4) 消毒用エタノール(EtOH80)。 別名エチルアルコール。濃度80%前後。
(5) 無水エタノール(EtOH99.5)。 99.5%エタノール。名前は無水だが若干の水分を含む。
(6) アンモニア水。 濃度10%。漂白の添加剤として使う。
(7) オキシドール。 過酸化水素水3%水溶液。 漂白に使う。
(8) クローブオイル。 別名丁子油。 写真はアロマオイル用。 刀剣用は合成されたまったくの別物なのでたぶん使えない。
(9) カナダバルサム。 購入したときは固まりでしたので、 キシレンを入れてやわらかくして使ってます。 けっこう時間がかかったような気がします。
(10) 酸性フクシン。 25gで8,000円ほどします。 ezo-aphidさん曰く「一生かかっても使い切れないでしょう」。 共同購入を検討してください。
(11) 酢。 料理用の酢です。KOHの中和用に使います。
(12) 蒸留水。 薬品を調整するとき使うようです。 けっこう高いです。 精製水とか浄水器を通した水でも大丈夫かもしれません。
(13) 中性洗剤。 台所用の中性洗剤を水でといたものです。 検体の洗浄に使ってます。
(14) クエン酸。 廃液の中和用。 ダイソーで買ったものがあったのでクエン酸を使ってます。
フタ付きの小さな容器で強アルカリに侵されないものを使います。 材質としては、磁器、ガラス、ポリプロピレンが使えそうです。 低温(50°C以下?)で処理する場合は、 ポリエチレン、ポリスチレン(実績があるみたい)、 AS樹脂、ABS樹脂等も使えるかもしれません。 ガラスは高濃度のアルカリに溶けるらしいのですが 使っている人もいるようなので問題ないのかもしれません。 ポリスチレン、AS樹脂、ABS樹脂はキシレンに溶けるので注意してください。 口の広い方が実体顕微鏡で覗けるので良いです。 円筒状の容器の場合 括れがあるとそこに検体が貼り付いて困ることがあるので 試験管のように段差の無い方が良いです。 底の形状は鈍角のV底か丸底のものが良いと思います。 平底だと コナジラミの蛹殻は平たいので貼り付きやい(貼り付くとピペットで吸えない)、 検体が広がってしまい一回のピペット操作で吸えななくなる、 ピペットでつぶしてしまう可能性が高くなる、 等の理由でやりにくいと思います。 V底でも、先が細くてピペットが底まで届かなくなるようだと、 検体を吸い上げられないかもしれません。 容量は2mlもあれば十分です。
食器とか化粧品用のケースとかの中に使えそうなものがあると思うのですが、 田舎のお店で探してみるてもなかなか見つかりません。
おすすめ?
東急ハンズで扱っている丸底ドラムという商品が、
今のところ一番具合が良さそうな気がしますが、
まだ試してません。
1個73円、丸底、ポリプロピレン製、3ml、自立可能、フタ付き、覗きやすい。
フタも透明であると良かったんですが。
丸底ドラム 3ml < ハンズネット
ルツボ
Dooley2002にはルツボ(磁器製?)を使うように書かれているようです。
下のようなものがネットで購入できます。
10個入りでフタと合わせて7,000円ほどしますね。
形状的に使いやすいかどうかは、使ってみないとわからないです。
るつぼ 5ml < テックジャム
KOH処理後はここで作業します。 薬品をたらしたとき検体が外側に移動することがあるため、 大きいと検体を中央に集める作業で時間を取られるので、 ある程度小さい方が良いのです。 私は直径30mmのものを使用しています(探した中では最小)。 プラスチック製だとヘラが引っかかってやり難い気がしますので、 ガラスか陶磁器が良いと思います。 黒い蛹殻の場合は背景は白い方が見やすく、 白い蛹殻の場合は背景は黒い方が見やすいです。 透明なガラス製の場合は下に紙を敷くなどして対応できるので、 一つで済みます。
土台とフタをつけると作業性が大幅に向上します。
全体がガラス製が良いのですが、
私はポリプロピレン製の容器に時計皿を埋め込んで自作しました。
ポリスチレンとかAS樹脂はキシレンに侵されるので使えません。
時計皿と容器の間にセメダインXクリアを充填したのですが、
泡が入って見づらくなってしまいました。
ポリプロピレン自体もいくらか拡散するので、
時計皿の裏側は中空にした方が良さそうです。

Dooley2002に出てくる Wilkey micro tool set は、
アメリカのbioquipという会社から購入できるようです。
コナジラミの場合の使い勝手とか気になるので、
試された方は教えてください。
http://www.bioquip.com/Search/DispProduct.asp?pid=4831
私は以下に述べる3種類の道具を自作しました。

Fig. 1-x つっつき棒、ヘラ2種、ピック、シリンジ3本 |
ステンレス製の針金に柄をつけたものです。
検体の掃除、ポンピング、移動、カナダバルサムの広げ等に使います。

作り方
(1) 竹製の割り箸を半分ぐらいの長さに切り、先端の角を少し削っておきます。
先端に針金の太さより少し大きい穴をあけます。
深さは5mmぐらい?
(2) 太さ0.5mm長さ3cmぐらいのステンレス針金の先端を少し曲げ、
セメダインX(白が良い)をつけて、
割り箸の穴に差し込みます。
割り箸の先端部分にセメダインXを塗りたくっておきます。
(3) 固まったら先端を600番ぐらいの耐水ペーパーで研ぎます。
丸くてツルツルにすると滑って使えません。
両刃のカミソリ刃を切って柄をつけたものです。
蛹殻を葉っぱからはがすとき、移動するとき、表裏をひっくり返すとき、カバーグラスを落とすときに使います。
先端の幅は1mm〜2mmぐらいが良いと思います。


作り方
(1) 両刃のカミソリ刃を金切りばさみで適当な大きさにカットします。
(2) 竹製の割り箸を半分ぐらいの長さで切り、先端の角を少し削っておきます。
割り箸の先端にカミソリ刃がはまる溝を掘ります。深さは5mmぐらい?
私は金工用の糸鋸の細いものを使いました。
(3) カットした刃をセメダインXホワイトで柄に接着します。
割り箸の先端にセメダインXを塗りたくっておきます。
(4) 固まったら先端をラジオペンチ等で少し曲げます。
微針に柄をつけたものです。
検体に穴をあける、成虫を引きずり出す、検体の表裏をひっくり返す等に使います。
一本爪より3本爪の方が使いやすいです。
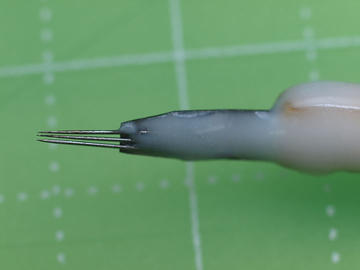
作り方
(1) 両刃カミソリをカットしてプレートを作ります。
(2) 昆虫標本作成用の微針(0.15mm)をカットして、
セメダインXホワイト(クリアは強度が低い)でプレートに貼付けます。
(3) ヘラと同じようにして柄に接着します。
注射器に似ていますが針の先端が水平にカットされたものです。 時計皿の液体を捨てるときに使います。 接着剤注入用注射器、シリンジ、インジェクター等の名前で販売されているようです。 針が別売になっていることがあるので、その場合は合わせて購入します。 写真は昔ダイソーで購入したもので、 化粧品用スポイドという名目で売ってました。
薬品をスポイト瓶に移動するとき、 検体をサンプルチューブから時計皿に移動するときに使います。 KOH用に2mlのピペットが1本あれば良いかな。 100%アルコール移動はポリエチレン製のスポイトを使い、 他のアルコール、キシレンは瓶を傾けて注ぐ(液体によっては危険)。 ピペットの先端のシリコンゴム製の部品(これもスポイトという)は 別売になっているので、合わせて購入します。
時計皿の液体を廃棄するのに使います。 特にアルコールは時計皿全体に広がるのでシリンジでは奇麗に吸い取れません。 必要に応じて細く切って使います。

作業中に発生した廃液はクエン酸水溶液を入れた廃液瓶に入れ、 ときどきまとめて流しに捨てています。 クエン酸は水酸化カリウムを中和するためのもので、 十分多めに入れておきます。 クエン酸は100円ショップで購入したものが手持ちにあったので使っていますが、 酸性のものならなんでも良いと思います。
水溶性の薬品中で使用した道具は、 必要なら廃液瓶で中和し、水ですすぎ、 布やティッシュで拭きます。
スライドガラスの大きさは、26mm x 76mmが標準みたいです。 厚さは1mmと1.3mmがありますが、 軽い方が良いかと思って1mmのものを使ってます。 色は水色(ソーダガラスの色)と白色(透明度が高い)がありますが、 顕微鏡の他の部分での影響の方がはるかに大きいようなので、 安い水色の方を使ってます。 縁は切りっぱなしと研磨したものがありますが、 少し高いのですが研磨した方を使ってます。 メーカーは武藤と松波を試しましたが、 松波のはホコリが大量に付着していて、 2度と買うまいと誓いました。
カバーバラスは、 大きさが18mm x 18mm、厚さ約0.17mmが標準みたいです。
無水硫酸銅を作るために使います。
KOH水溶液以外の薬品はスポイト瓶に移して使っています。
小さい方が10ml、大きい方は30mlです。
※写真を撮影した時期とやり方が少し変わっており、
すべて10mlでも良いかもしれません。

スポイト瓶の色は透明なのと茶色いのがありますが、
茶色い方が光で変質することが少なくて良いのかもしれません。
形は四角い方が、ホルダーを作ればの話ですが、
片手でフタを回せるので良いかと思います。
紙とペンと糊が必要になります。

紙は厚めの方が良いらしいです。
私は名刺用の紙を使ってます。
ペンは顔料インクのボールペンを使います。
プリンタを使う場合も
顔料インクのインクジェットプリンタ(そういうのがあるらしい)を使います。
糊は木工ボンドを使ってます。
白いコナジラミは処理していくと透明になって背景が白だと全く見えなくなります。 時計皿の下にこの黒い板を置くと多少マシです。 キシレンにつけた状態ではほとんど見えなくなりますが…。 照明は時計皿の横からLEDライト等で照らすと良いかもしれません(まだ試してない)。
スポイト瓶は四角いので適当なホルダーを作ってやると、 片手でフタを回せると便利そうですし整頓された状態で作業できそうです。 現在はテーブルの上に瓶とフタがすぐに散乱し、とても非効率的です。
(1) まず無水硫酸銅を作ります。 作り方は、 硫酸銅(II)を蒸発皿の上で加熱し、 白くなるまでスプーンでかき混ぜ続けます。 量は使用する広口瓶の1/4ぐらいで良いと思います。 バーナー、セラミック金網(昔の石綿金網)、三脚台等を使います。 YouTubeでビデオが見れるので参考にしてください▶ 硫酸銅加熱變化 。 この映像の途中で白くなった状態が無水硫酸銅です。 水を加えてはいけませんよ。 私はバーナーを買わずにキャンピング用のコンロを使いましたが、 火力が下げられずやりにくかったような記憶があります。
(2) できた無水硫酸銅を100ccくらいの広口瓶に入れ、 そこに無水エタノール(99.5%)を注ぎます。 特に危険は無かったように記憶していますが…。 ※水の場合はたぶん危険。
(3) そのまま数時間静置します。
(4) 上澄み液が透明になったら、 ピペットで静かに上澄み液を吸い取ってスポイト瓶に移します。
(5) 広口瓶の方はフタをして保管します。 少なくなってきたら無水エタノールを補充してください。 無水硫酸銅が青くなってきたら再度加熱すれば再利用できます。
100mlの水に10gの水酸化カリウムを溶かした溶液を作ります( 濃度は適当で良いと思います)。 水は浄水器を通した水道水を使ってます。 保存はポリエチレン製中栓付き容器にしまいます。 ガラス容器は少しずつ溶けるようです。
ひどく危険ということはありませんが、 KOH水溶液が目に入ると失明する可能性があるらしいので注意してください。 KOH水溶液が手に付いた場合はすみやかに洗い流してください (すぐにどうということはありません)。 溶かすときに蒸気や目に見えない飛沫が飛び散るので、 換気扇を回しながら作業してください。 水を先に入れてください。 水酸化カリウムに水を注ぐと危険らしいです。 水酸化カリウムは潮解性があるので瓶のフタはすぐにしめましょう。
(1) キッチンスケールなど(1g単位ではかれる重量計)に紙等を敷き、 水酸化カリウムのペレットをスプーンで10g計りとります。
(2) ポリエチレン製の広口瓶に水を100ml入れます。
(3) 計った水酸化カリウムを少しずつ広口瓶に入れていきます。
(4) かき混ぜてフタをして静置します。
(5) スプーンは使用後中和して水ですすぎます。
普通は70%エタノールに1%の酸性フクシンを溶かすらしいですが、 ただの水に溶かしたもので大丈夫そうです。 私は適当に水に溶かしたので現在の濃度は不明です。 少量を計る方法が思い浮かばなかったのですが、 楊枝の先を削って小さなスプーンを作る等の方法で試してみたいと思いますので、 しばらくお待ちください。
中和用の酢を入れておいても良さそうなので試してみようと思います。
紙に文字を書き、それを両面テープで瓶に貼り、 透明な粘着テープを上から貼って防水します。 粘着テープはポリプロピレン製のScotchの透明美色とかが良いと思います。 セロハンテープは長期間使用していると汚くなって崩れてくるので。
ヘラの上につっつき棒を使って載せ、移動先でつっつき棒を使ってヘラから下ろします。 移動先が液体の場合はヘラを振るだけ済むかもしれません。 ヘラに載せるとき液体が多い場所では難しいので 液体を減らすか時計皿の外側に移動して行います。
つっつき棒で背面側から軽く押さえます(腹面側は強度的に弱い)。 蛹殻内部の液体が排出され、 棒をはなすと蛹殻は元に戻るので、液体が交換されます。
時計皿の検体がいない場所に、シリンジを垂直に立てて、液体を吸い上げます。 隙間をあけないようにすれば、吸い込まれることはありません。 よく失敗しますが。
ティッシュを細くちぎって、 時計皿の液体に触れさせて吸い上げます。 液体が少なくなってきたら傾けても大丈夫。 アルコールの場合は時計皿の外側に広がるので拭くようにして取り除きます。
液体が蒸発して乾燥してしまった場合、 その状態で触らずに、 液体を加えてください。 乾燥した状態では壊れやすいです。
(1) 採集
(2) 選別
(3) 剥離
(4) 脱ロウ(蛹越冬個体)
(5) 穴あけ(硬いもの)
(6) KOH処理
(7) 脱脂(白い蛹殻)
(8) 中和(染色も漂白もしない場合)
(9) 染色(白い蛹殻)
(10) 漂白(黒い蛹殻)
(11) 脱水
(12) クローブオイル
(13) マウント(バルサム)
(14) ラベリング
黒い蛹殻が丸まってしまうことがあって理由がよくわかりません。
3齢以下
小さくてとても扱い難いです。
4齢になったばかり
やわらかくて扱い難いです。
4齢後期〜蛹初期
一番やりやすいかもしれません。
蛹中期
成虫の体が中途半端にできていて、
KOHでも溶けず引きずり出そうにも崩れるという状態で、
どうにもならんです。
蛹後期
成虫の体ができてくるとKOHでは溶けないので、
引きずり出す必要があって、
うまく引きずり出せても、だいたい汚くなってしまいます。
羽化殻
頭胸部が脱落しやすいです。
新しいものは比較的簡単に標本を作れます。
白いものはそのまま簡易検鏡できます。
古いものはカビが付着していて、あまり奇麗には仕上がりません。
越冬個体
落葉樹の葉っぱについたまま蛹の状態で越冬する個体です。
ワックスが多く油分が多く、手間がかかります。
晩秋に採集したものは
4齢後期〜蛹初期段階にあり処理しやすいです。
寄生されているもの
中の寄生蜂の蛹ができていたら取り出す必要があります。
蛹殻も通常とは変化しているようで、やめておいた方が良さそうです。
ヘラを使い蛹殻を葉っぱからはがします。 このときヘラにEtOH80等をつけて行うと具合が良いです。 液体をつけないとコナジラミが弾き飛ばされることが多くて往生します。
文献[Malumphy2009]にアルコール煮沸をしろと書いてあったのですが、 未調査です。
落ち葉についたまま蛹越冬する種類は分厚いワックスの覆われており、 先にキシレンで除いた方が安定するような気がします。 4.2で剥離した検体はEtOH99を入れた時計皿に落とします。 複数個体をまとめて処理している場合は、時計皿にEtOH99が 無くなってきたら補充してください。 EtOH99はそのままで、キシレンを2滴ほど加え、フタをして静置します。 5分ほど後、つっつき棒でつっついて、ワックスの固まりを落とします。 多少残っていてもかまいません。 キシレンを排出。 EtOH99を投入しEtOH99を排出。 洗剤投入。
外皮が硬く厚みのある検体の場合、 検体の腹面側に穴をあけます。 文献には穴をあけるなと書かれているのですが、 外皮の硬い検体の場合はKOH処理後ポンピングするときに、 管状孔から中身が出てくることがあり、 この場合は管状孔の部品が取れることが多いです。
あける場合は重要な場所を避け 裏側の中央よりやや下あたりにピックで穴をあけます。
10%水酸化カリウム水溶液に浸けて内容物を溶かします。 状態にもよりますが、通常は常温では難しそうで、 温度をあげる装置が必要になります。 電子ジャーの保温機能(細かく温度が設定できるもの)、 湯煎、保温調理器等を使います。
KOH処理は2回行い、途中で一回ポンピングを行います。 温度が高い状態で検体をつっつかないように注意してください (もろくなってます)。
KOH(15分@70°C) → 常温でつっつく → KOH(5分@70°C) → 洗剤。
(1)
サンプルチューブにKOH水溶液を0.5mlほど入れる。
その中に検体を入れてフタをする。
同じ種類の検体をまとめて10〜20個体ぐらい入れても大丈夫。
(2) ホルダーにセットして、保温器具の中に入れる。
時間は5分〜15分くらい?
添付した表を参考にしてください。
(3) KOH溶液ごとピペットで吸い上げて検体を時計皿に移します。
できるだけ溶液は残す。
(4) 温度を下げるためKOHを加えます。
もしKOHが多かった場合は先にいくらか排出します。
(5) 背面側からつっつき棒でポンピングして掃除します。
中に成虫がいたら溶け難いので、引きずり出してください
(中途半端な成虫は引きずり出すのが困難です)。
(6) ヘラですくって、サンプルチューブに戻します。
KOHが少ない場合は補充してください。
(7) 再度保温容器にしまいます。
時間は〜5分くらい?
(8) KOH溶液ごとピペットで吸い上げて検体を時計皿に移します。
(9) KOH溶液を排出します。
(10) 洗剤を加えて、つっつきます。
| 状態 | 穴あけ | 1回目 | 2回目 |
|---|---|---|---|
| 落葉樹越冬個体、黒、大きさ1.3mm | あり | 15分@70°C | 5分@70°C |
白いコナジラミの場合、 これをやらないとうまく染まらないような気がしてます。
洗剤 → EtOH99 → EtOH99+キシレン(5分) → EtOH99 → EtOH80 → 洗剤
もし染色も漂白もしない場合は、中和処理だけ行います。 酢を2滴ほど投入してポンピングし フタをして5分(てきとう)ほど静置します。
染色は白い蛹殻(透徹処理が終了すると透明になる)の場合に行います。 黒い場合は次の漂白処理へ。
酸性フクシンでいったん濃く染めた後、
EtOH80を通して適当な濃さになるまで静置します。
(1) 酢を1滴と染色液を1滴を投入(染色液に酢を入れておいても良いかも)。
フタをして2時間(@20°C)以上置く。
(2) ヘラで別の時計皿に移動し、
すべて移動したらEtOH80を投入する。
ポンピングしてフタをする。
染めるよりも早く薄まるので、
観察しながら適当な色になるまで静置します(やや濃いめで)。
(3)
ポンピングすると色のついた液体が放出されますから、
すぐに脱水作業に移ります(EtOH99.5から)。
染色液が残った状態で高濃度のアルコールを投入すると
フクシンが析出して汚くなるので。
種類によって、うまく染まらないことがあるようです。 温度を上げてどうなるか。
漂白は黒い蛹殻の場合に行います。 漂白し過ぎは元に戻れませんのでご注意を。
(1) KOHの中和を兼ねるため、酢を1滴加えてポンピングし
酢は少し残して捨てます。
(2) オキシドールを3滴とアンモニア水を1滴加えフタをして常温で静置します。
(3) 別のことをしながらときどきチェックし、
適当な濃さになったら、
液体を捨てて速やかに次の4.11の脱水作業に移ります。
(4) 30分ほどしても完了しない場合は、
液体を捨てて(2)からやり直します。
KOH処理でいくらか色が薄くなっている場合は比較的短時間で終わります。 10分 〜 60分(30分 x 2回)ぐらいでしょうか…。
2回目以降はあまり進展がないような気がします。 深い部分は遅いのかもしれません。 温度を上げると時間を短縮できるかどうか。
(1) アルコールを垂らす、ポンピング、ティシュで拭う という作業をアルコールの濃度をあげながら繰り返します。 特に時間を置く必要はないと思います。 濃度は以下のような感じで上げていきます。 EtOH80 -> EtOH99.5 -> EtOH99.5 -> EtOH100 -> EtOH100。
クローブオイルを2滴ほど加えて、 軽くつついて沈めます。 フタをして常温で30分ほど置きます。
1枚のスライドに複数の個体を載せるようにします。 効率的ですし、カバーガラスの水平性を得るのに有利です。 私は通常6個体ほど載せています。 そのうち2個体ほどは腹面側を表にします。 できるだけ格子状に揃えて並べます。 そうすると顕微鏡でアクセスが楽になるので。 また斜めに傾かないようにしたほうが、複数毎撮影して合成する場合に楽です。 小さな気泡は1日くらいたつと消えるので、ほっておいて大丈夫です。 大きな気泡はカバーガラスを押して排出します。
位置と方向を揃えるため以下のようにしています。
必ず気泡が入るのですが、小さな気泡はそのうち消えます。
(1)
スライドグラスに検体を移します。
位置はだいたいでよく、
表裏だけ確認しておきます。
クローブオイルは付いていても大丈夫だと思います。
(2)
中央付近にゆるゆるに調整したカナダバルサムを1滴落とし、
スライドグラスの範囲の少し内側まで広げます。
(3)
検体の位置と方向を揃えます。
(4)
スライドガラスを極めて慎重に落とします。
現在は位置合わせ用のガイド(まだ試してない)とヘラを使ってます。
専用のピンセットを作った方が楽かもしれません。
(5)
スライドガラスの4辺からカナダバルサムを垂らして吸い込ませます。
大きな気泡が残ったら極めて慎重に押し出します。
小さな気泡はそのうち消えるので、そのままで大丈夫です。
自然乾燥では完全に固まるまでに2ヶ月〜1年かかるようです。 50度Cで1週間ぐらい静置しておくと良いらしいです。 専用の装置はすごく高いので、 電球の下に置いておくとかの方法でできるかどうか 試してみようと思ってます。

白い紙を25mm x 25mm程度の大きさにカットします。 紙は厚いものを使えと書いてありましたが[どこだったか?]、理由はわかりません。 私は手持ちにあった名刺用の紙を使いました。
必ず顔料系のインクのペンを使います。 染料系のインクは長い時間が経つと色が薄くなって消えてしまうので使えません。 私は顔料系インクのボールペンを使っています。 プリンタでも顔料系インクのインクジェットプリンタというのがあるらしいです。
文献[鳥倉1996]に木工ボンド(酢酸ビニル樹脂エマルジョン接着剤)を 使えと書いてあったので、そのようにしています。 おそらく水で剥がせるためだろうと思います。 カナダバルサムは水に溶けませんのでラベルだけ剥がすことができます(たぶん)。
おおむねDooley2002に従いましたが、 場所は県名まで入れ、 日付の書き方は日から書く方法にしました (どっちが主流なのか良くわかりません)。 それから、性別はよくわからないので私は書いてません。 多数の個体が採集できた場合は、 大きいの(おそらく雌)と小さいの(そそらく雄)を 1枚のスライドにマウントしています。 アブラムシの文献[田中1967]に検体は上下逆さまに置けと書いてありましたが、 なんとなく世界標準ではないみたいなので採用してません。 管理コードは任意です。 左側は追記できるように、できるだけ空白をあけておきます。 封入剤の情報は再封入するときに必要になるのだろうと思います。
| Aleyrodidae (科名) |

|
Japan Yamanashi (採集場所) |
| Parabemisia maculata Tak. (コナジラミ学名) | Acer japonicum (ホスト学名) | |
| G. Nanashi (同定者) | date:22-X-2013 (採集日) | |
| (確認者) | coll: G. Nanashi (採集者) | |
| Balsam (封入剤) | SL57 (管理コード) |